肺静脉隔离术治疗慢性房颤在心脏手术中的应用
靖文斌 陈铁男 郭志鹏 闫英群 刘晓程
(泰达国际心血管病医院 心外科,天津 300457)
[摘要]
目的:房颤是心脏瓣膜疾病患者中常见的心律失常。术前为房颤心律的患者在接受瓣膜手术后有75%仍为房颤。本研究旨在对于因其他心脏疾病合并慢性房颤需接受手术治疗的患者,评估在术中采用肺静脉隔离术同时治疗房颤的近中期效果。
研究方法:29名患者(男性12例,41.4%,女性17例,58.6%)在进行心脏手术的同时,接受了肺静脉隔离术治疗房颤。其中单纯风湿性心脏病患者27例(93.1%),单纯冠心病1例(3.4%),风心病合并冠心病1例(3.4%)。房颤病史36[11, 120]个月(中位数[四分位数])(其中1例为阵发性房颤)。所有患者均在术中同时行肺静脉隔离术,个别加做左心房减容术。使用社会科学统计软件包即SPSS(Statistical Package for the Social Science, SPSS 13.0 for Windows, Chicago IL)进行数据统计与分析。
结果:6例(20.7%)术中同时行左心房减容术,10例(34.5%)合并心房血栓的患者术中行心房血栓清除术。主动脉阻断时间85.83+24.036min,体外循环时间134.28+30.975min。25例为术后心脏自动复跳(86.2%),余4例经除颤后复跳。复跳后心脏节律24例(82.8%)为窦性,5例(17.2%)为结性心律。4例(13.8%)因心率偏慢在术后应用临时起搏器,无术后安装主动脉球囊反搏、永久起搏器者。术后复查心电图,窦性节律25例(86.2%),结性节律1例(3.4%),房颤节律3例(10.3%)。所有患者均康复出院,术后住院天数13.69+5.745天。出院后共有16名患者接受随访,随访时间18.20+16.755个月,失访率44.8%。14例(占被访者比例86.7%)仍维持窦性节律,2例(13.3%)为房颤。随访患者中有1例于术后3个月死于心功能衰竭(房颤节律),1例患肺癌。
结论:外科实施肺静脉隔离术应用于慢性房颤的治疗,手术操作技术相对更为简单,无需射频或冰冻消融,心房肌及窦房结动脉损伤机会减少,减少了术中术后并发症的发生,可减少患者经济负担。无论从技术上还是经济上比较,都更加便于推广。
正文:
房颤是心脏瓣膜疾病患者中常见的心律失常。术前为房颤心律的患者在接受瓣膜手术后有75%仍为房颤。[1, 2]抗心律失常药物以及内科介入治疗对于保持窦性心律及减少潜在的生命威胁均效果不佳。而术后转复为窦性心律可以恢复房、室的正常收缩功能,减少左房血栓的发生,改善患者心悸、呼吸困难、易疲劳等自觉症状,因而在施行二尖瓣手术的同时手术治疗房颤具有重要意义。对于因其他心脏疾病合并慢性房颤需接受手术治疗的患者,如能在术中同时治疗房颤,也可以有效地改善患者生活质量,并具有一定的经济意义。本院自2005年11月至2009年12月,为29名此类患者在术中行肺静脉隔离术(及左心房减容术),取得满意效果,汇报如下。
1. 材料与方法
1.1 患者基本资料
29名患者(男性12例,41.4%,女性17例,58.6%)在进行心脏手术的同时,接受了肺静脉隔离术治疗房颤。其中单纯风湿性心脏病患者27例(93.1%),单纯冠心病1例(3.4%),风心病合并冠心病1例(3.4%)。瓣膜病类型见表一。
表一 瓣膜病类型及比例
|
瓣膜病类型 |
例数 |
比例(%) |
|
无 |
1 |
3.4 |
|
MS |
5 |
17.2 |
|
MS+MI |
3 |
10.3 |
|
MS+AI |
1 |
3.4 |
|
MS+AS+AI |
1 |
3.4 |
|
MS+TI |
9 |
31.0 |
|
MI+TI |
1 |
3.4 |
|
MS+MI+TI |
3 |
10.3 |
|
MS+AS+TI |
1 |
3.4 |
|
MS+AI+TI |
1 |
3.4 |
|
MS+MI+AI+TI |
3 |
10.3 |
|
Total |
29 |
100.0 |
合并胆石症2例(6.9%),下肢栓塞2例(6.9%),肺气肿1例(3.4%),风湿性关节炎1例(3.4%)。房颤病史36[11, 120]个月(中位数[四分位数])(其中1例为阵发性房颤)。
病例的选择适应证及禁忌证如下:
适应证:18至75岁之间,持续性房颤1年以上经内科治疗无效,包括经药物控制心率而不能耐受心律失常者或不能耐受所需的药物治疗;至少有一次血栓栓塞病史;房颤合并其他心脏疾病,需同期进行心脏手术的。术前向患者详细说明情况,包括即将采取的治疗术式、可能的后果等。经伦理委员会审核通过后,自愿加入的患者方可入选。研究过程中患者有权随时退出。
排除标准/手术禁忌证:单纯慢性房颤而无其他心脏疾病的患者;年龄小于18岁;房颤病史不足6月;左室射血分数低于20%;妊娠;二次手术;心包粘连;恶性肿瘤;严重慢性阻塞性肺病;肾功能不全需要透析治疗;内分泌功能紊乱,如嗜铬细胞瘤,甲亢,未经治疗的甲减;滥用药物和酗酒;精神异常;孕妇,哺乳期妇女;不同意手术者。
1.2 手术方式
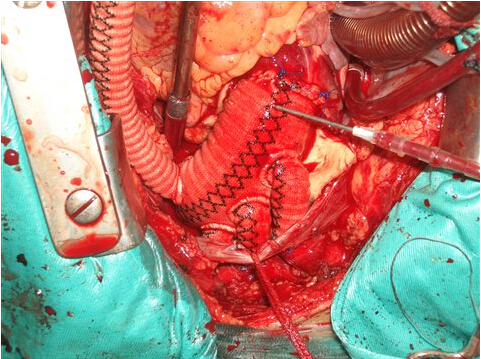
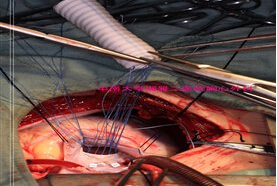
肺静脉隔离手术操作技术:胸骨正中切口,上腔静脉直角插管,常规建立体外循环。充分游离上腔静脉及左房顶,常规阻断上、下腔静脉及主动脉,心肌保护,于上腔静脉汇入右房口上1-2cm横断上腔静脉,平行房间沟作左房切口并环形延伸至四个肺静脉口外侧。二尖瓣病变患者可通过此切口行二尖瓣置换术,瓣膜处理完后,使环形切口汇合将肺静脉口完全从左房后壁切下,注意避免损伤冠状动脉、冠状静脉窦,切除左心耳并在心耳根部缝闭。用4/0prolene线连续缝和将肺静脉口重新缝回左房后壁,5/0prolene线将上腔静脉与右房重新缝合,处理心脏瓣膜病或其他心脏疾病,缝合心脏切口,术闭置右心室心外膜临时起搏导丝或房、室顺序起搏导丝。常规脱机,关胸。
左房减容技术:对于左心房明显增大的患者(LA-Ds前-后>65mm),经上述环形切口,将左心房进行环形切除,以张力适当,不影响肺静脉口与左房后壁重新吻合为宜。余操作同上。
术中、术后监测指标:主动脉阻断时间、体外循环时间、心脏自动复跳情况、心脏复跳后节律类型、临时起搏器应用情况、术后呼吸机带机时间、并发症发生情况、出院时心功能分级等,统计患者ICU居留时间、术后住院时间等指标。
远期随访内容包括:心功能分级、心脏节律、房颤复发情况、是否安装永久起搏器等。
1.3 统计方法
使用社会科学统计软件包即SPSS(Statistical Package for the Social Science, SPSS 13.0 for Windows, Chicago IL)进行数据统计与分析。当P值<0.05时,认为对应数据间的差异具有显著性意义。根据各类数据特点,正态分布的数据多组间比较采用方差检验(One-Way ANOVA)。对重复检测的数据进行重复测量设计的方差分析。正态分布的数据以“均值+标准差”或“均值+标准误”表示,非正态分布数据以“中位数 [四分位数]”表示,计数资料以“个数(百分比)”表示。
2 结果
所有患者均为择期手术。手术术式见表二,瓣膜种类见表三。6例(20.7%)术中同时行左心房减容术,10例(34.5%)合并心房血栓的患者术中行心房血栓清除术。主动脉阻断时间85.83+24.036min,体外循环时间134.28+30.975min。25例为术后心脏自动复跳(86.2%),余4例经除颤后复跳。复跳后心脏节律24例(82.8%)为窦性,5例(17.2%)为结性心律。4例(13.8%)因心率偏慢在术后应用临时起搏器,无术后安装主动脉球囊反搏、永久起搏器者。
表二 手术术式分布
|
手术术式 |
例数 |
比例(%) |
|
单瓣置换术(及瓣膜成形术) |
24 |
82.8 |
|
单纯冠脉搭桥术 |
1 |
3.4 |
|
双瓣置换术(及瓣膜成形术) |
3 |
10.3 |
|
双瓣置换术(及瓣膜成形术)+冠脉搭桥术 |
1 |
3.4 |
|
Total |
29 |
100.0 |
表三 瓣膜种类
|
瓣膜种类 |
例数 |
比例(%) |
|
无 |
1 |
3.4 |
|
机械瓣 |
25 |
86.2 |
|
生物瓣 |
3 |
10.3 |
|
Total |
29 |
100.0 |
1例(3.4%)患者因创面渗血行二次开胸探查止血。所有患者术后均顺利脱离呼吸机,无长期居留ICU、气管切开病例。术后当天、第3天、第7天,各有1例出现房颤复发。7例(24.1%)因房颤或窦性心动过速经静脉或口服应用胺碘酮。术后复查心电图,窦性节律25例(86.2%),结性节律1例(3.4%),房颤节律3例(10.3%)。所有患者均康复出院,术后住院天数13.69+5.745天。术前、术后心脏功能(NYHA)分级、左房直径(LA-Ds前-后)、左室射血分数(LVEF)对比见表四。
表四 术前、术后心脏功能比较
|
|
术前 |
术后 |
P |
|
心功能分级(NYHA) |
2.59+0.682 |
2.28+0.455 |
0.048 |
|
左房直径(LA-Ds前-后,mm) |
55.23+8.622 |
44.04+4.609 |
0.000 |
|
左室射血分数(LVEF,%) |
60.38+7.206 |
58.04+5.173 |
0.194 |
出院后共有16名患者接受随访,随访时间18.20+16.755个月,失访率44.8%。14例(占被访者比例86.7%)仍维持窦性节律,2例(13.3%)为房颤。随访患者中有1例于术后3个月死于心功能衰竭(房颤节律),1例患肺癌。
3 讨论
理想的治疗房颤的手术方法应满足以下5个要求:①消除房颤;②保持窦性节律;③重建和/或保持房室同步性;④保持心房传输功能;⑤减少或消除因双心房内淤血而形成血栓的风险。由Cox提出的迷宫Ⅲ型手术是治疗难治性房颤的安全、有效的手术技术。但手术过程中对心房组织的广泛、多重的切割、缝合,导致手术操作复杂,体外循环时间延长,术中失血较多,并有损伤冠状动脉、增加术后起搏器应用比例的风险,增加了围术期并发症发生的几率[3]。由于上述原因,此手术只能在一些十分有经验的医疗中心开展,而限制了其在临床上的应用。为了使更多的患者接受治疗,人们提出了多种在迷宫Ⅲ型手术基础上的改进方法。[4, 5]Haissaguerre指出肺静脉异位冲动可以诱发阵发性房颤,在此处消融可以消除这一心律失常。[6]在动物[7]和人[8]的心房标测数据显示心房后壁与房颤持续存在有关,在心房特定区域消融可以治疗房颤。有报道指出在房颤发生时,并不是整个心房组织都与其有关,而是一部分心房活动相对规律,另一部分则完全不规则。基于对上述房颤产生及维持的电生理机制的进一步深入了解,人们提出了肺静脉隔离手术这一治疗房颤的新方法。Sueda[9]及Imai[10]报道,房颤发生时最短的ff间期发生于左房后壁的左肺静脉边缘及左心耳基底部,并根据这一理论发明了针对继发于二尖瓣疾病房颤患者集中于左房后壁的外科手术方法。术后6月,78%的患者无房颤发生,61%恢复左房收缩力,长期随诊74%消除房颤。[4]其他学者[11, 12]也应用冷冻、射频消融[11, 12, 13, 14]或外科切口[15]施行左房后壁手术,中期随诊显示窦性心律转复率为70-80%。事实上,早在1998年即有学者报道通过肺静脉隔离术治疗房颤。[16]近来,多位学者指出导管消融肺静脉隔离术后房颤复发的主要原因是由于局部消融不彻底,消融能量未达到心外膜,心肌暂时水肿引起传导阻滞,术后5-12天传导恢复后房颤复发,而第二次重新消融后,复发率明显下降。[17]而外科切割手术恰好避免了这一缺点。与迷宫手术不同的是,肺静脉隔离术在左心耳根部至肺静脉口环形切口间无切口;无需冷冻、射频消融;右房及房间隔上无切口,简化了手术。比较本研究中术前术后的心脏功能、左房直径,其改善均具有统计学意义(P<0.05),LVEF无显著变化。Renato AKK等证实,肺静脉隔离术后6个月随访,仍有92.3%保持窦性节律。[15] 本研究中,出院后共有16名患者接受随访,随访时间18.20+16.755个月。其中14例(占被访者比例86.7%)仍维持窦性节律,2例(13.3%)为房颤。与Renato等人的随访情况相比,平均随访时间(8.20+16.755个月)较长,且维持窦性节律的比例仍较高,说明外科肺静脉隔离术可有效治疗慢性房颤。此外,以往的研究仅在二尖瓣手术的同时施行肺静脉隔离术。本研究扩大了肺静脉隔离术的手术指征,认为凡是需要进行开胸手术的患者,如合并慢性房颤,均可在术中一并治疗。29例患者中有1例为冠心病合并慢性房颤,术后心脏节律恢复窦性,效果满意。
Lima GGD等[18]比较了迷宫手术与肺静脉隔离术,发现后者的安全性更高,而治疗房颤的效果与前者相近。个别学者也报道了采用部分隔离肺静脉,剩余部分追加冷凝治疗(-60℃,120sec)的成功病例。[3]此外,由于二尖瓣疾患造成的左心房扩大会导致心肌细胞传导速度和不应期出现不一致,可能导致房颤复发和血栓形成,在左心房较大的患者还可延左心房切口做环形切除,以减少左房容积,减少房颤复发的几率。
4 结论
外科实施肺静脉隔离术应用于慢性房颤的治疗,手术操作技术相对更为简单,无需射频或冰冻消融,心房肌及窦房结动脉损伤机会减少,减少了术中术后并发症的发生,可减少患者经济负担。无论从技术上还是经济上比较,都更加便于推广。
本研究的样本量较小(n=29),且随访失访率较高(44.8%),因此对肺静脉隔离术治疗慢性房颤的手术结果、随访结果仍有一定的局限性。在随后的研究中,将进一步扩大样本数量,完善随访资料,以期客观反映本术式的各项情况。
参考文献:
[1] Kalil RAK, Maratia CB, D’Avila A, Ludwig FB. Predictive factors for persistence of atrial fibrillation after mitral valve operation. Ann Thorac Surg 1999; 67: 614-7.
[2] Jessurun ER, van Hemel NM, Kelder JC, et al. Mitral valve surgery and atrial fibrillation: is atrial fibrillation surgery also needed? Eur J Cardiothorac Surg 2000; 17: 530-7.
[3] Yasushi Matsumoto, Go Watanabe, Masamitsu Endo, et al. Encircling Isolation of Pulmonary Vein Orifice for Elimination of Persistent Atrial Fibrillation Associated with Mitral Valve Disease. J Card Surg 2003; 18: 415-8.
[4] Sueda T, Nagata H, Orihashi K, et al. Efficacy of a simple left atrial procedure for chronic atrial fibrillation in mitral valve operation. Ann Thorac Surg 1997; 63: 1070-5.
[5] Melo JQ, Neves J, Adragao P, et al. When and how to report results of surgery on atrial fibrillation. Eur J Cardiothorac Surg 1997; 12: 739-45.
[6] Haissaguerre M, Jais P, Shah DC, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339: 659-66.
[7] Fieguth HG, Wahlers T, Borst HG. Inhibition of atrial fibrillation by pulmonary vein isolation and auricular resection-experimental study in a sheep model. Eur J Cardiothorac Surg 1997; 11: 714-21.
[8] Gaida F, Riccardi R, Calo L, et al. Atrial mapping and radiofrequency catheter ablation in patients with idiopathic atrial fibrillation: electrophysiological findings and ablation results. Circulation 1998; 97: 2136-45.
[9] Sueda T, Nagata H, Shikata H, et al: Simple left atrial procedure for chronic atrial fibrillation associated with mitral valve disease. Ann Thorac Surg 1996; 62: 1796-800.
[10] Imai K, Sueda T, Orihashi K, et al. Clinical analysis of results of a simple left atrial procedure for chronic atrial fibrillation. Ann Thorac Surg 2001; 71: 577-81.
[11] Tuinenburg AE, Van Gelder IC, Tieleman RG, et al. Mini-Maze suffices as adjunct to mitral valve surgery in patients with preoperative atrial fibrillation. J Cardiovasc Electrophysiol 2000; 11: 960-7.
[12] Gaita F, Gallotti R, Calo L, et al. Limited posterior left atrial cryoablation in patients with chronic atrial fibrillation undergoing valvular heart surgery. J Am Coll Cardiol 2000; 36: 159-66.
[13] Kottkamp H, Hindricks G, Hamnel D. Intraoperative radiofrequency ablation of chronic atrial fibrillation: a left atrial curative approach by elimination of anatomic “anchor” reentrant circuits. J Cardiovasc Electrophysiol 1999; 10: 772-80.
[14] Haissaguerre M, JaisP, Shah DC, et al. Catheter ablation of chronic atrial fibrillation targeting the reinitiating triggers. J Cardiovasc Electrophysiol 2000; 11: 2-10.
[15] Kalil RAK, Lima GG, Leiria TL, et al. Simple surgical isolation of pulmonary veins for the treatment of secondary atrial fibrillation in mitral valve disease. Ann Thorac Surg 2002; 73: 1169-73.
[16] Madhu Sankar N, Farnsworth AE. Left atrial reduction for chronic atrial fibrillation associated with mitral valve disease. Ann Thorac Surg 1998; 66: 254-6.
[17] Noguchi H, Kumagai K, Yasuda T, et al. Conduction recovery after pulmonary vein isolation for atrial fibrillation. Circ J 2005; 69: 65-8.
[18] Lima GGD, Kalil RAK, Leiria TL, et al. Randomized study of surgery for patients with permanent atrial fibrillation as a result of mitral valve disease. Ann Thorac Surg 2004; 77: 2089-95.
(君健网www.junjian99.com独家刊登,如需转载请注明出处并保留完整信息)
瓣膜性心脏病合并心房颤动术中双极... 上一篇 | 下一篇 改良迷宫手术治疗心房纤颤
- 经胸右室穿刺封堵婴儿室间隔缺损25例报告2014-12-15
- 风湿性心脏病瓣膜置换术后焦虑与抑郁状况分析2014-12-10
- 高海拔地区59例双瓣膜置换术的临床分析2014-12-10
- 肺动脉夹层动脉瘤综述2014-12-15
- 马凡综合征主动脉根部瘤的改良Bentall术治疗2014-12-15
- 深低温停循环后梯度灌注复温脑保护的实验研究2014-12-15
- 组织工程血管基质的制备及保存2014-12-15
- 胸腔镜下体外循环心脏手术10例报道2014-12-15
- 原位心脏移植患者术后远期随访与分析2014-12-15
- 全球首个在“移植子宫”内孕育的婴儿降生2014-12-10
-
医生姓名:刘伏友
所在科室:肾内科
工作医院:中南大学湘雅二医院
专业职称:主任医师
擅长疾病: 腹膜透析、各类肾病、慢性肾功能衰竭、尿毒症、血液...