
蔡露,美国华人糖尿病学会(CADA)倡导人之一,现任学会主席。2007年4 月至今任美国路易斯韦尔大学副教授,兼任吉林大学和温州医学院客座教授和温州医学院中美糖尿病并发症研究所所长。担任美国糖尿病学会、美国心脏病学会等众多基金项目的评审委员,兼任三十多种知名学术期刊的编委、审稿人并撰写特约述评。
杨俊玲,教授、主任医师,在原白求恩医科大学第二临床学院呼吸内科工作,参与我国“十一五”重大课题全国慢性肺源性心脏病流行病调查研究,并作为访问学者在蔡露教授实验室工作。
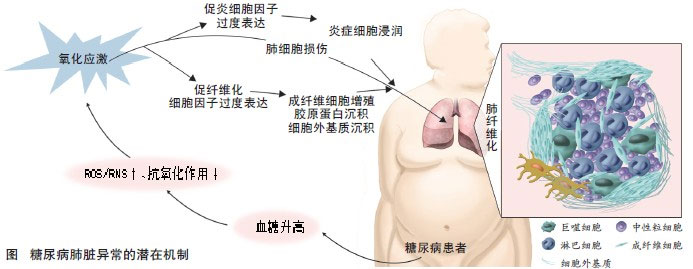
图注:糖尿病高血糖导致蛋白质非酶促性糖基化反应,依次产生过多的活性氧分子(ROS)和(或)活性氮分子(RNS),损伤肺组织的抗氧化防御功能,即氧化应激。氧化应激也能直接损伤肺组织细胞,刺激促炎细胞因子(TNF-α、PAI-1等)和促纤维化细胞因子(TGF-β、CTGF等)以及基础生长因子的过度表达,导致炎症反应、胶原和细胞外基质沉积,上述病理改变均将导致肺纤维化。
早在20年前就有人提出,肺脏应被视为糖尿病的“靶器官”之一。虽然大量观察性研究结果表明,糖尿病患者存在肺功能异常,但此前尚未明确这种异常是否与糖尿病直接相关。新近一项临床研究显示,糖尿病与肺功能异常呈正相关。一项涉及40项研究的荟萃分析也证实了糖尿病与肺功能异常的正性关联。另有报道显示,限制性而非阻塞性肺功能障碍与2型糖尿病明显相关。上述研究结果意味着,与糖尿病肾病和心肌病一样,糖尿病所致肺纤维化也是糖尿病并发症之一。由于肺纤维化会对心脏功能造成严重影响,值得引起临床医生高度重视。
临床证据揭示现象
1型和2型糖尿病患者均可能出现肺功能异常。上世纪70年代的一项研究表明,60%的糖尿病患者在病程早期即出现肺功能异常,在低肺容积时的弹性回缩力明显小于对照组。此外,糖尿病患者肺总量明显减小,有假说认为这种肺弹性功能异常是弹性蛋白和胶原蛋白异常的表现。
数项研究证实,糖尿病患者肺功能异常指标主要包括用力肺活量、肺总量、弥散功能[一氧化碳弥散量(DLco)及单位肺泡一氧化碳弥散量(DLco/VA)],但第1秒用力呼气容积(FEV1)除外。上述肺功能指标异常在儿童或成年糖尿病患者,以及1型和2型糖尿病患者中均可观察到。然而,糖尿病病程、血糖水平以及合并症状态是否与肺功能异常的严重程度相关仍有争议。
多项研究显示,成人1型糖尿病患者存在明显的限制性肺功能障碍,而成人2型糖尿病患者多表现为肺弥散功能损伤。最新一项入选7万余例糖尿病患者和5万余名非糖尿病对照者的回顾性纵向队列研究证实,在确诊糖尿病的人群中,哮喘、阻塞性肺疾病、肺纤维化和肺炎发生率显著高于对照组,而肺癌发病率则相似。校正年龄、性别、种族、吸烟状态、体质指数、教育程度、酒精消耗量、门诊复查等因素后,上述差异依然显著。
新近一项涉及40项研究的荟萃分析也显示,糖尿病常伴随适度却有显著差异的限制性肺功能障碍。糖尿病诱发的肺纤维化与吸烟相似,且多数研究者认为,糖尿病患者肺弥散功能减退和换气功能受限可能归因于肺泡和毛细血管壁增厚以及间质增宽,以上表现均为肺间质损伤和纤维化的标志。
基础研究探讨机制
组织结构异常
组织学检查表明,糖尿病诱发的肺纤维化主要表现为炎症细胞浸润、胶原和细胞外基质过度沉积以及肺泡-毛细血管屏障基底膜损伤,后者对于决定纤维化进展的不可逆性起决定作用。糖尿病诱发的肺泡组织和毛细血管壁的微血管病变会导致肺容量减少和肺泡气体交换受限。
动物试验表明,硫脲霉素诱导的糖尿病大鼠模型8周时出现肺间质炎症细胞明显浸润伴肺泡隔扩张和胶原沉积,16周时出现细胞外基质沉积导致肺泡腔狭窄,肺泡隔肥厚呈弥漫性多病灶分布,局部也可见。
对61例糖尿病患者的尸检结果显示,肺脏微血管病变主要以增厚的上皮细胞和毛细血管基底膜、血管透明样变、纵隔内结节样纤维化、肉芽肿形成和局灶性蛋白沉积为特征,被认为是一种特殊类型的结节性纤维化。有学者对不同严重程度、不同病程的糖尿病患者进行肺血管组织检测后发现,这些组织的微血管病变与其他脏器(肾脏和皮肤)相似,表现为肺巨噬细胞在肺泡腔内的聚集。增厚的肺泡间隔、细胞外基质和胶原过度沉积以及肺泡毛细血管损伤很可能直接导致限制性肺功能异常。有学者认为,糖尿病患者肺脏内胶原蛋白和弹性蛋白增加可能部分源于结缔组织蛋白分解减少。因此,上述组织病理学改变可归因于糖尿病所致的分子和细胞学异常。
生物化学变化
糖尿病肺脏结构与功能异常均源于生物化学变化。数项研究证实,神经病变和心肌病变等糖尿病并发症均由高血糖导致的蛋白质过度非酶性糖基化所诱发。被称为晚期糖基化终末产物蛋白(AGE)的物质在糖尿病患者和动物体内增多,并促发级联反应导致内皮功能障碍和血管损伤进展。虽然正常状态下AGE在肺组织内分布有限,但AGE受体却分布广泛。当血糖水平升高时,AGE在肺组织中过度产生,与受体相互作用后引起细胞内氧化应激性损伤,增加了血管通透性。
氧化应激被认为是各种糖尿病并发症的主要诱因之一。一些类脂的氧化或过氧化产物能与蛋白质结合,扩大糖基化作用的损害。一氧化氮合酶(NOS)介导的NO过度产生被认为在糖尿病诱发的肺纤维化过程中发挥重要作用。
值得一提的是,细胞内氧化应激和随后活化的氧化还原-敏感性转录因子NF-κB也被认为是导致糖尿病晚期并发症的关键。NF-κB是一种通过活性氧分子活化的多效性因子,能通过转录激活编码促炎症反应细胞因子(TNF-α、IL-1和IL-12)的基因、细胞黏附分子及活性氮分子。NF-κB抑制剂被证实能保护硫脲霉素诱导的糖尿病大鼠模型的肺脏,减轻肺泡基底膜增厚和肺间质单核炎症细胞浸润程度。
促炎症反应和细胞黏附分子对于糖尿病肺纤维化也很重要。例如,1型和2型糖尿病患者内皮细胞选择素水平明显升高,进一步反映了包括肺血管床在内的全身内皮损伤,并能促进糖尿病肺功能障碍进展。
此外,越来越多证据表明,某些生长因子持续过度产生也与糖尿病肺纤维化有关,如成纤维细胞生长因子和转化生长因子-β1(TGF-β1),后者是肺纤维化发生发展的重要介质,能诱导促纤维化反馈回路的形成,导致细胞外基质过度产生。有学者推断,浸润的炎症细胞长时间产生TGF-β1导致了胶原蛋白在糖尿病肺组织中过度积聚。我们的前期研究也显示,链脲霉素诱导的糖尿病小鼠模型肺组织中血浆纤溶酶原激活物抑制物-1、结缔组织生长因子和纤维结合蛋白的mRNA和蛋白质表达水平均受到明显的正调控。
与其他糖尿病并发症一样,增强的氧化应激可能是引起糖尿病肺纤维化的主要原因,增加的活性氧分子(ROS)和(或)活性氮分子(RNS)通过诱导促炎症反应因子和促纤维化因子直接或间接损伤肺组织,导致间质细胞外基质堆积和纤维化,最终造成肺功能障碍(图)。虽然肺脏尚未被视为糖尿病的主要靶器官,但糖尿病患者肺部并发症(尤其是肺纤维化)较想象中更常见,且肺部结构异常通常与视网膜、肾脏、外周神经和骨骼肌异常合并出现。限制性肺功能损伤与2型糖尿病和致死性心血管疾病关系已被揭示,且前者会进一步放大糖尿病状态下的其他器官损伤,进而加速糖尿病患者出现心血管疾病。因此,我们必须较既往更加重视糖尿病肺损伤,进一步研究其机制及潜在干预方法。
病例报告:糖尿病合并焦虑、抑郁一... 上一篇 |下一篇 糖尿病性皮肤瘙痒应对有方
- 苦瓜粥2009-11-04
- 糖尿病食谱 冬瓜鲤鱼汤2009-12-23
- 桂黄韭菜粥2009-11-04
- 糖尿病食谱 山竹石斛生鱼汤2009-12-23
- 地骨皮粥2009-11-04
- 周末多补觉可防糖尿病2013-08-02
- 吃完就困,血糖在报警2013-07-02
- 绿豆麦片粥2009-11-04
- 五味巴戟粥2009-11-04
- 糖尿病食谱 鲈鱼汤2009-12-23
-
医生姓名:刘伏友
所在科室:肾内科
工作医院:中南大学湘雅二医院
专业职称:主任医师
擅长疾病: 腹膜透析、各类肾病、慢性肾功能衰竭、尿毒症、血液...













